O ouro se destaca dos outros metais por ter uma coloração muito bonita, sendo dourado e brilhante, enquanto a maioria dos outros metais é de cor prateada. Em uma das músicas analisadas ele é mencionado assim: “Amarelo lembra ouro” (Novinha Você é Uma Flor; Mcs Thin e Alexandre, 2018). Ele também é resistente à oxidação, pois é um metal nobre e não reage com o oxigênio, portanto não perde o seu brilho (VENABLE, 2011:XVIII). Isso o distingue do cobre, por exemplo, que também é amarelo-avermelhado e brilhante, mas que com o tempo vai se desgastando e perdendo esse brilho, ficando esverdeado. Uma curiosidade é que a Estátua da Liberdade foi feita de cobre, mas muitos não sabem disso, pois hoje em dia ela possui uma cor esverdeada por causa da oxidação (NEWTON, 2010:151).
 Figura 01 – Comparação entre ouro e cobre: Enquanto a Estátua da Liberdade rapidamente se oxidou (adquirindo um tom esverdeado) por ter sido feita de cobre, o sarcófago de Tutancâmon preservou muito melhor seu brilho dourado. Fonte: Newton (2010:151 e 225)
Figura 01 – Comparação entre ouro e cobre: Enquanto a Estátua da Liberdade rapidamente se oxidou (adquirindo um tom esverdeado) por ter sido feita de cobre, o sarcófago de Tutancâmon preservou muito melhor seu brilho dourado. Fonte: Newton (2010:151 e 225)
O símbolo do ouro (Au) vem do latim “aurum”, derivado de vocábulos ligados a “brilho”, sendo esse uma de suas características marcantes e que é mencionada em diversos versos de músicas, como: “Você brilha como ouro” [you shine like gold] (Gold, Oberhofer, 2012); “Mas você é ouro para mim e eu amo a maneira que você brilha” [but you are gold to me and i love the way you shine] (Gold, Ellie Holcomb feat. Carly Bannister, 2021); “Com todo seu brilho / E todo o seu ouro” [with all your glitter / And all your gold] (Glitter & Gold, Rebecca Ferguson, 2011); “Brilha que nem ouro” (Ouro, Pabllo Vittar part. Urias, 2018); “Em um mundo onde você sente frio / Você tem que permanecer ouro” [In a world where you feel cold / You gotta stay gold] (Stay Gold, BTS, 2020), que quer dizer, em um mundo onde você se sente desconfortável ou quando se sente triste, você tem que permanecer radiante, ou seja, tem que permanecer alegre, “brilhando” como o ouro.
Esse brilho é dado pelas partículas de luz (fótons) absorvidas e refletidas pelo ouro. Em qualquer metal, o brilho gerado pela exposição à luz ocorre quando o fóton atinge o átomo: quando isso acontece, os elétrons absorvem a energia e saltam para um nível de energia maior, logo depois retornando ao seu nível original, e assim liberando essa energia absorvida, dando cor ao material. No caso do ouro, em função do grande tamanho de seu núcleo (79 prótons), seus elétrons se movem muito rapidamente (mais do que a metade da velocidade da luz; WALKER, 2006). Isso faz com que, devido a um efeito relativístico, os elétrons ganhem massa, e com isso se aproximem do núcleo. Isso aumenta a distância entre a última camada eletrônica ocupada do átomo de ouro, e a de nível energético superior, aumentando assim a frequência da luz absorvida pelo átomo. Assim, o átomo de ouro absorve as ondas de luz azul e violeta e reflete todas as outras, sendo as principais delas vermelho e verde, que juntas formam o amarelo (SCARINCI e MARINELI, 2014:12).
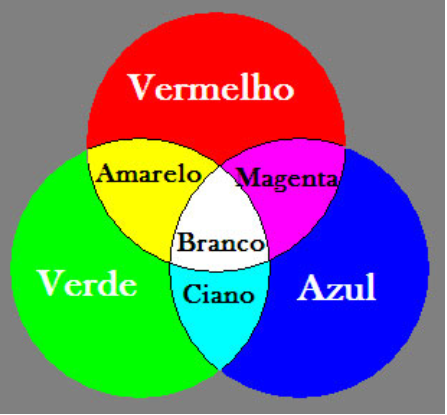
Figura 02 – Cores primárias de Emissão: Como explicam Scarinci e Marinelli (2014:5), essa figura mostra as 3 cores primárias da luz (o vermelho, o azul e o verde), as resultantes das misturas das cores 2 a 2, chamadas de cores secundárias da luz (o amarelo, o ciano e o magenta), e a resultante da mistura das 3 cores primárias, que é o branco. Metais normalmente emitem igualmente as 3 cores primárias, que então resultam em um brilho esbranquiçado. O ouro, porém, devido aos efeitos relativísticos mencionados, emite a cor azul em menor intensidade, resultando em um brilho mais amarelado. Fonte: Scarinci e Marinelli (2014:5, Figura 4)
O ouro chamou muita atenção de povos antigos, estando ligado à cultura e história de vários deles. Por ser um metal tão belo e com alta durabilidade, ele já foi até considerado como “objeto advindo dos deuses”, pelos Maias, Astecas e Incas (JUNQUEIRA et al., 2012:45). Ele também foi considerado o símbolo do Sol pelos alquimistas (RSC s.d.), e segundo Paul Strathern: “O ouro é relacionado ao sol, cujo dia da semana é domingo” (Strathern, 2002:63). Em uma das músicas é dito, “Você vai se esquecer do Sol no seu céu ciumento / Enquanto caminhamos em campos de ouro” [You’ll forget the sun in his jealous sky / As we walk in fields of gold] (Fields of Gold; Sting, 1993), como se esse campo de ouro fosse tão belo e brilhante, que até nos esquecemos do brilho do sol, deixando-o com ciúmes.
A beleza desse metal é um dos fatores que o fazem ser muito valioso, caro e cobiçado, fazendo com que ele tenha sido usado em joias, moedas e obras de arte há milhares de anos (NEWTON, 2010:223). O fato de o ouro ser um metal maleável e dúctil, podendo ser inclusive considerado frágil, já que é fácil de amassar (McDOWELL, 2008:40), também contribui para o seu valor estético. Essa beleza é frequentemente usada nas músicas como metáfora para algo que, além de belo, é delicado, como pode ser visto no trecho abaixo.
“Ouro na ponta dos seus dedos / Pontas dos dedos contra minha bochecha / Folha de ouro em seus lábios / Beije-me até que eu não possa falar”
“Gold on your fingertips / Fingertips against my cheek / Gold leaf across your lips / Kiss me until I can’t speak”
(Hostage, Billie Eilish, 2017)
Fonte:
JUNQUEIRA, Jéssica S. S; SILVA, Priscila P; GUERRA, Wendell. 2012. Ouro. Química Nova na Escola 34:45-46.
McDOWELL, Julie. 2008. Gold. In: Metals. New York: Chelsea House, pp.40-1.
NEWTON, David E. 2010. Chemical elements. Detroit: Gale.
RSC. s.d. Gold. Royal Society of Chemistry. Acessível em: https://www.rsc.org/periodic-table/element/79/gold
SCARINCI, Anne L.; MARINELI, Fábio. 2014. O modelo ondulatório da luz como ferramenta para explicar as causas da cor. Revista Brasileira de Ensino de Física 36(1):1309.
STRATHERN, Paul. 2002. O sonho de Mendeleiev: a verdadeira história da química. Rio de Janeiro: Jorge Zahar.
VENABLE, Shannon L. 2011. Gold: a cultural encyclopedia. Santa Barbara, Califórnia: ABC-CLIO.
WALKER, John. 2006. What gives gold that mellow glow? Fourmilab. Acessível em: https://www.fourmilab.ch/documents/golden_glow/