Visão Global
O alumínio é encontrado na linha 2, grupo 13 da tabela periódica. A tabela periódica é um gráfico que mostra como os elementos químicos estão relacionados entre si. Elementos na mesma coluna geralmente têm propriedades químicas semelhantes. O primeiro elemento desse grupo é o boro. No entanto, o boro é muito diferente de todos os outros membros da família. Portanto, o grupo 13 é conhecido como família de alumínio. O alumínio é o terceiro elemento mais abundante na crosta terrestre, ficando atrás do oxigênio e do silício. É o metal mais abundante. Surpreende, portanto, que o alumínio tenha sido descoberto relativamente tarde na história da humanidade. O alumínio ocorre naturalmente apenas em compostos, nunca como um metal puro. Remover o alumínio de seus compostos é bastante difícil. Um método barato para produzir alumínio puro não foi desenvolvido até 1886.
Símbolo
Al
NÚMERO ATÔMICO
13
MASSA ATÔMICA
26.98154
FAMÍLIA
Grupo 13 (IIIA)
Alumínio
Hoje, o alumínio é o metal mais utilizado no mundo depois do ferro. É usado na fabricação de automóveis, materiais de embalagem, equipamentos elétricos, máquinas e construção civil. O alumínio também é ideal para latas e folhas de cerveja e refrigerantes, pois pode ser derretido e reutilizado ou reciclado.
Descoberta e nomeação
O alumínio foi nomeado para um de seus compostos mais importantes, o alume. O alúmen é um composto de potássio, alumínio, enxofre e oxigênio. O nome químico é sulfato de alumínio e potássio, KAl (SO 4 ) 2 .
Ninguém sabe ao certo quando o alume foi usado pela primeira vez por seres humanos. Os antigos gregos e romanos estavam familiarizados com o alume composto. Foi extraído no início da Grécia, onde foi vendido aos turcos. Os turcos usaram o composto para fazer um belo corante conhecido como vermelho da Turquia. Registros indicam que os romanos estavam usando alume desde o primeiro século a.C.
Essas pessoas primitivas usavam o alume como adstringente e mordente. Um adstringente é um produto químico que faz com que a pele se junte. Polvilhar alume sobre um corte faz com que a pele se feche sobre o corte e inicie sua cicatrização. Um mordente é usado no pano de tingimento. Poucos corantes naturais grudam diretamente no tecido. Um mordente se liga ao tecido e o corante se liga ao mordente.
Com o tempo, os químicos começaram gradualmente a perceber que o alume poderia conter um novo elemento. Em meados da década de 1700, o químico alemão Andreas Sigismund Marggraf (1709-82) afirmou ter encontrado uma nova “terra” chamada alumina no alume. Mas ele não conseguiu remover um metal puro do alume.
A primeira pessoa a realizar essa tarefa foi o químico e físico dinamarquês Hans Christian Oersted (1777-1851). Oersted aqueceu uma combinação de alumina e amálgama de potássio. Um amálgama é uma liga de metal e mercúrio. Nesta reação, Oersted produziu uma amálgama de alumínio – metal de alumínio em combinação com mercúrio. Ele não conseguiu, no entanto, separar o alumínio do mercúrio.
Hoje, o alumínio é o metal mais utilizado no mundo depois do ferro.
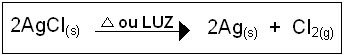
O metal de alumínio puro foi finalmente produzido em 1827 pelo químico alemão Friedrich Wöhler (1800-82). Wöhler usou um método aperfeiçoado pelo químico inglês Sir Humphry Davy (1778-1829), que conseguiu isolar vários elementos durante sua vida. Wöhler aqueceu uma mistura de cloreto de alumínio e metal potássio. Sendo mais ativo, o potássio substitui o alumínio, conforme mostrado a seguir:
O alumínio puro pode então ser coletado como um pó cinza, que deve ser derretido para produzir o alumínio brilhante que é mais familiar para os consumidores.
Após o trabalho de Wöhler, foi possível, mas muito caro, produzir alumínio puro. Custou tanto que quase não havia usos comerciais para ele.
Vários químicos perceberam o quanto era importante encontrar uma maneira mais barata de preparar o alumínio. Em 1883, o químico russo VA Tyurin encontrou uma maneira mais barata de produzir alumínio puro. Ele passou uma corrente elétrica através de uma mistura fundida (derretida) de criolita e cloreto de sódio (sal comum de mesa). A criolita é o fluoreto de alumínio e sódio (Na 3 AlF 6 ). Nos anos seguintes, métodos semelhantes para isolar o alumínio foram desenvolvidos por outros químicos na Europa.
O avanço mais dramático na pesquisa sobre alumínio foi realizado por um estudante universitário nos Estados Unidos. Charles Martin Hall (1863-1914) era um estudante do Oberlin College em Oberlin, Ohio, quando se interessou pelo problema da produção de alumínio. Usando equipamento caseiro em um galpão de madeira atrás de sua casa, ele obteve sucesso ao passar uma corrente elétrica através de uma mistura fundida de criolita e óxido de alumínio (Al 2 O 3 ).
O método de Hall era muito mais barato que qualquer outro método anterior. Após sua descoberta, o preço do alumínio caiu de cerca de US $ 20 / kg (US $ 10 / lb) para menos de US $ 1 / kg (cerca de US $ 0,40 / lb). A pesquisa de Hall mudou o alumínio de um metal semiprecioso para um que poderia ser usado em muitos produtos do cotidiano.
Propriedades físicas
O alumínio é um metal prateado com um tom levemente azulado. Possui um ponto de fusão de 660 ° C (1.220 ° F) e um ponto de ebulição de 2.327-2.450 ° C (4.221-4.442 ° F). A densidade é de 2,708 gramas por centímetro cúbico. O alumínio é dúctil e maleável. Dúctil significa ser capaz de ser puxado para fios finos. Maleável significa capazes de serem martelados em folhas finas.
O alumínio é um excelente condutor de eletricidade. Prata e cobre são melhores condutores que alumínio, mas são muito mais caros. Os engenheiros estão procurando maneiras de usar o alumínio com mais frequência em equipamentos elétricos por causa de seus custos mais baixos.
Propriedades quimicas
O alumínio tem uma propriedade interessante e muito útil. No ar úmido, combina-se lentamente com o oxigênio para formar óxido de alumínio:
O óxido de alumínio forma um revestimento esbranquiçado muito fino no metal de alumínio. O revestimento evita que o metal reaja mais com o oxigênio e protege o metal contra corrosão adicional (ferrugem). É fácil ver o óxido de alumínio nos móveis de exterior de alumínio e no revestimento da casa sem pintura.
O alumínio é um metal bastante ativo. Reage com muitos ácidos quentes. Também reage com álcalis. Um alcalino é um produto químico com propriedades opostas às de um ácido. Hidróxido de sódio (lixívia comum) e água de cal são exemplos de álcalis. É incomum para um elemento de reagir com ambos os ácidos e álcalis. Dizem que esses elementos são anfotéricos.
O alumínio também reage rapidamente com água quente. Em pó, pega fogo rapidamente quando exposto a chamas.
Alumínio: Metal precioso?
Antes dos químicos desenvolverem modos de baixo custo para a produção de alumínio puro, ele foi considerado um metal precioso. De fato, em 1855, uma barra de metal de alumínio puro foi exibida na Exposição de Paris. Ele foi colocado ao lado das joias da coroa francesa! O alumínio é um excelente condutor de eletricidade.
Ocorrência na natureza
A abundância de alumínio na crosta terrestre é estimada em cerca de 8,8%. Ocorre em muitos minerais diferentes.
A bauxita, uma complicada mistura de compostos que consiste em alumínio, oxigênio e outros elementos, é a principal fonte comercial de alumínio.
Grandes reservas de bauxita são encontradas na Austrália, Brasil, Guiné, Jamaica, Rússia e Estados Unidos. O maior produtor de metal de alumínio são os Estados Unidos; Os estados que produzem mais alumínio são Montana, Oregon, Washington, Kentucky, Carolina do Norte, Carolina do Sul e Tennessee.
Isótopos
Existe apenas um isótopo de alumínio que ocorre naturalmente, o alumínio-27. Isótopos são duas ou mais formas de um elemento. Os isótopos diferem entre si de acordo com o número de massa. O número gravado à direita do nome do elemento é o número da massa. O número de massa representa o número de prótons mais nêutrons no núcleo de um átomo do elemento. O número de prótons determina o elemento, mas o número de nêutrons no átomo de qualquer elemento pode variar. Cada variação é um isótopo.
O alumínio possui seis isótopos radioativos. Um isótopo radioativo libera energia ou partículas subatômicas para reduzir a massa atômica e se tornar estável. Quando a emissão produz uma alteração no número de prótons, o átomo não é mais o mesmo elemento. As partículas e a energia emitida pelo núcleo são chamadas radiação. O processo de decomposição de um elemento para outro é conhecido como deterioração radioativa.
Nenhum isótopo radioativo de alumínio tem uso comercial.
Extração
A produção de alumínio é um processo de duas etapas. Primeiro, o óxido de alumínio é separado da bauxita pelo processo Bayer. Nesse processo, a bauxita é misturada ao hidróxido de sódio (NaOH), que dissolve o óxido de alumínio. Os outros compostos da bauxita são deixados para trás.
O óxido de alumínio é então tratado com um processo semelhante ao método de Hall. Não há criolita natural suficiente para produzir todo o alumínio necessário; portanto, a criolita sintética (artificial) é fabricada para esse fim. A reação química é a mesma com o criolito sintético e com o criolito natural. Cerca de 21 milhões de toneladas de alumínio foram produzidas em 1996 por esse processo de duas etapas.
Usos
O alumínio é usado como metal puro, em ligas e em uma variedade de compostos. Uma liga é feita derretendo e misturando dois ou mais metais. A mistura tem propriedades diferentes das dos metais individuais. As ligas de alumínio são classificadas em séries numeradas de acordo com os outros elementos que contêm.
A classificação 1000 é reservada para ligas de metal de alumínio quase puro. Eles tendem a ser menos fortes do que outras ligas de alumínio, no entanto. Esses metais são utilizados nas partes estruturais dos edifícios, como guarnições decorativas, em equipamentos químicos e como refletores de calor.
A série 2000 é uma liga de cobre e alumínio. São muito fortes, resistentes à corrosão (ferrugem) e podem ser usinado ou trabalhado com muita facilidade. Algumas aplicações das ligas de alumínio da série 2000 são em painéis de caminhões e peças estruturais de aeronaves.
A série 3000 é composta de ligas de alumínio e manganês. Essas ligas não são tão fortes quanto a série 2000, mas também têm boa usinabilidade. As ligas desta série são usadas para utensílios de cozinha, tanques de armazenamento, móveis de alumínio, placas de sinalização rodoviária e coberturas.
As ligas da série 4000 contêm silício. Eles têm baixos pontos de fusão e são usados para fazer soldas e adicionar cor cinza ao metal. As soldas são ligas de baixo ponto de fusão usadas para unir dois metais entre si. As séries 5000, 6000 e 7000 incluem ligas constituídas por magnésio, magnésio e silício e zinco, respectivamente. Eles são usados na produção de navios e embarcações, peças para guindastes e suportes de armas, pontes, peças estruturais em edifícios, peças de automóveis e componentes de aeronaves.
O maior uso único de alumínio está no setor de transporte (28%). Fabricantes de carros e caminhões, como o alumínio e ligas de alumínio porque são muito fortes e leves. As empresas estão usando mais produtos de alumínio em carros elétricos. Esses carros devem ser leves para economizar energia da bateria. General Motors, Ford e Chrysler anunciaram projetos avançados de carros novos, nos quais os produtos de alumínio serão usados mais extensivamente. Os produtores de alumínio também planejam fabricar uma variedade maior de rodas para carros e caminhões.
Vinte e três por cento de todo o alumínio produzido chega às embalagens. Folhas de alumínio, latas de cerveja e refrigerantes, tubos de tinta e recipientes para produtos domésticos, como sprays de aerossol, são todos feitos de alumínio.
Quatorze por cento de todo o alumínio é destinado à construção civil. Janelas e caixilhos de portas, telas, coberturas e revestimentos, assim como a construção de casas móveis e partes estruturais de edifícios, dependem do alumínio.
Os 35% restantes de alumínio entram em uma gama impressionante de produtos, incluindo fios e eletrodomésticos, motores de automóveis, sistemas de aquecimento e refrigeração, pontes, aspiradores de pó, utensílios de cozinha, móveis de jardim, máquinas pesadas e equipamentos químicos especializados.
Compostos
Uma quantidade relativamente pequena de alumínio é usada para fazer uma grande variedade de compostos de alumínio. Esses incluem:
sulfato de amónio de alumínio (Al (NH 4 ) (SO 4 ) 2 ): mordente, purificação de água e de tratamento de efluentes, produção de papel, aditivo alimentar, curtimento de couro
borato de alumínio (Al 2 O 3 B 2 O 3 ): produção de vidro e cerâmica
boro-hidreto de alumínio (Al (BH 4 ) 3 : aditivo em combustíveis para aviação
cloreto de alumínio (AlCl 3 ): fabricação de tintas, antitranspirante, refino de petróleo, produção de borracha sintética
fluorossilicato de alumínio (Al 2 (SiF 6 ) 3 ): produção de pedras sintéticas, vidro e cerâmica
hidróxido de alumínio (Al (OH) 3 ): antiácido, mordente, purificação de água, fabricação de vidro e cerâmica, impermeabilização de tecidos
fosfato de alumínio (AlPO 4 ): fabricação de vidro, cerâmica, produtos de celulose e papel, cosméticos, tintas e vernizes e na fabricação de cimento dentário
sulfato de alumínio ou alúmen (Al 2 (SO 4 ) 3 ): fabricação de papel, mordente, sistema de extintor de incêndio, purificação de água e tratamento de esgoto, aditivo alimentar, retardador de fogo e retardante de fogo, e curtimento de couro
Efeitos na saúde
O alumínio não tem função conhecida no corpo humano. Há algum debate, no entanto, sobre seus possíveis efeitos na saúde. Na década de 1980, alguns cientistas da área da saúde ficaram preocupados com o fato de o alumínio estar associado à doença de Alzheimer. Esta é uma condição que afeta mais comumente as pessoas idosas, levando ao esquecimento e à perda de habilidades mentais. Ainda não está claro se o alumínio tem algum papel na doença de Alzheimer.
Algumas autoridades acreditam que respirar poeira de alumínio também pode causar problemas de saúde. Pode causar uma condição semelhante à pneumonia atualmente chamada aluminose. Novamente, não há evidências suficientes para apoiar essa visão.
FONTE: Disponível em: <Chemistry Explained>. Acessado em: 18 de novembro de 2019.
Tradução: Ferramenta do Google
Revisão: Gabriel H. A. Martins